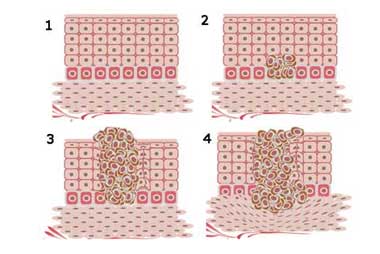
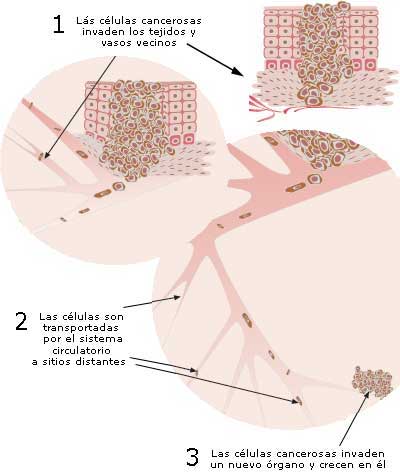
Los vacunados contra COVID‐19 corren mayor riesgo que los no vacunados
Fuente: Informed consent disclosure to vaccine trial subjects of risk of COVID‐19 vaccines worsening clinical disease https://doi.org/10.1111/ijcp.13795 – Department of Biochemistry and Molecular Pharmacology, NYU Langone Health, New York, NY, USA – Division of Comparative Pathology, Department of Pathology and Laboratory Medicine, Tulane University School of Medicine, Tulane National Primate Research Center, Covington, LA, USA
Las vacunas COVID ‐ 19 diseñadas para provocar anticuerpos neutralizantes pueden sensibilizar a los receptores de la vacuna a una enfermedad más grave que si no estuvieran vacunados. Existe un riesgo significativo para los sujetos que reciben las vacunas de que puedan experimentar una enfermedad grave una vez vacunados, mientras que solo pueden haber experimentado una enfermedad leve y autolimitada si no están vacunado. Los ensayos clínicos de fase 1 y 2 de vacunas candidatas solo se han diseñado en torno a la inmunogenicidad como un punto final de eficacia y no se han diseñado para capturar la exposición de los sujetos al virus circulante después de la vacunación, que es cuando está diseñado para que ocurra la mejora dependiente de anticuerpos (ADE) / inmunopatología. Por lo tanto, la ausencia de evidencia de ADE en los datos de la vacuna COVID ‐ 19 hasta ahora no exime a los investigadores de revelar el riesgo de aumento de la enfermedad a los participantes del ensayo de la vacuna, y sigue siendo un riesgo realista, no teórico para los sujetos.
Dada la fuerte evidencia de que el ADE es un riesgo no teórico y convincente para las vacunas COVID-19, la divulgación del riesgo específico de empeoramiento de la enfermedad COVID-19 debido a la vacunación requiere un tratamiento específico, separado en un formulario de consentimiento informado de facil comprensión del paciente para cumplir con los estándares de ética médica. El proceso de consentimiento informado para los ensayos en curso de la vacuna COVID-19 no parece cumplir con este estándar. Si bien la emergencia sanitaria mundial de COVID-19 justifica los ensayos acelerados de vacunas de candidatos con responsabilidades conocidas, tal aceleración no es incompatible con la atención adicional que se presta a los procedimientos de consentimiento informado específicos para los riesgos de la vacuna COVID-19.
Vigilancia de seguridad de la Adminsitación de Drogas y Alimentos, FDA: Lista de trabajo de posibles resultados de eventos adversos de las vacunas COVID-19
Sujeto a cambios
Síndrome de Guillain-Barré
Encefalomielitis diseminada aguda
Mielitis transversa
Encefalitis / mielitis / encefalomielitis /
meningoencefalitis / meningitis /
encefalopatía
Convulsiones / convulsiones
Accidente cerebrovascular
Narcolepsia y cataplejía
Anafilaxia
Infarto agudo de miocardio
Miocarditis / pericarditis
Enfermedad autoinmune
Muertes
Resultados del embarazo y el nacimiento
Otras enfermedades desmielinizantes agudas
Reacciones alérgicas no anafilácticas
Trombocitopenia
Coagulación intravascular diseminada
Tromboembolismo venoso
Artritis y artralgia / dolor articular
Enfermedad de Kawasaki
Síndrome inflamatorio multisistémico
en ninos
Enfermedad potenciada por la vacuna
 Fuente: Vaccines and Related Biological Products Advisory Committee October 22, 2020 Meeting
Fuente: Vaccines and Related Biological Products Advisory Committee October 22, 2020 Meeting
Presentation: https://www.fda.gov/media/143557/download
Resumen
Objetivos del estudio
El objetivo del estudio fue determinar si existe suficiente bibliografía para exigir a los médicos que revelen el riesgo específico de que las vacunas COVID ‐ 19 pueden empeorar la enfermedad tras la exposición al virus de desafío o en circulación.
Métodos utilizados para realizar el estudio
Se revisó la literatura publicada para identificar evidencia preclínica y clínica de que las vacunas COVID-19 podrían empeorar la enfermedad tras la exposición al virus de desafío o circulante. Se revisaron los protocolos de ensayos clínicos para las vacunas COVID ‐ 19 para determinar si los riesgos se informaron adecuadamente.
Resultados del estudio
Las vacunas COVID ‐ 19 diseñadas para provocar anticuerpos neutralizantes pueden sensibilizar a los receptores de la vacuna a una enfermedad más grave que si no estuvieran vacunados. Las vacunas para el SARS, MERS y RSV ( Respiratory syncytial virus ) nunca han sido aprobadas, y los datos generados en el desarrollo y prueba de estas vacunas sugieren una seria preocupación mecanicista: que las vacunas diseñadas empíricamente usando el enfoque tradicional (que consiste en el pico viral de coronavirus no modificado o mínimamente modificado para provocan anticuerpos neutralizantes), ya sea que estén compuestos de proteína, vector viral, ADN o ARN e independientemente del método de administración, pueden empeorar la enfermedad por COVID-19 a través de la mejora dependiente de anticuerpos (ADE). Este riesgo está lo suficientemente oculto en los protocolos de los ensayos clínicos y los formularios de consentimiento para los ensayos en curso de la vacuna COVID-19 que es poco probable que ocurra una comprensión adecuada de este riesgo por parte del paciente.
Conclusiones extraídas del estudio e implicaciones clínicas
El riesgo específico y significativo de ADE al ser vacunado contra COVID-19 debería haber sido y debería ser divulgado de manera prominente e independiente a los sujetos de investigación que actualmente se encuentran en ensayos de vacunas, así como a aquellos que están siendo reclutados para los ensayos y futuros pacientes después de la aprobación de la vacuna, para cumplir con los estándar ético de comprensión del paciente para el consentimiento informado.
1 EL RIESGO DE ADE EN LAS VACUNAS COVID-19 NO ES TEÓRICO
La intensificación de la enfermedad provocada por la vacuna se observó previamente en sujetos humanos con vacunas para el virus sincitial respiratorio (RSV, Respiratory syncytial virus), el virus del dengue y el sarampión. 1 También se observó una intensificación de la enfermedad provocada por la vacuna con los virus SARS y MERS y con el coronavirus felino, que están estrechamente relacionados con el SARS ‐ CoV ‐ 2, el patógeno causante de la enfermedad COVID ‐ 19. Los mecanismos inmunes de esta mejora han involucrado invariablemente a los anticuerpos, desde la mejora directa dependiente de anticuerpos, hasta la formación de complejos inmunes por los anticuerpos, aunque acompañada de diversas respuestas celulares coordinadas, como la distorsión de las células T Th2. 2 – 7 En particular, se ha implicado tanto a los anticuerpos neutralizantes como a los no neutralizantes. Un estudio reciente reveló una lesión pulmonar aguda mediada por IgG in vivo en macacos infectados con SARS que se correlacionó con una respuesta de anticuerpos neutralizantes provocada por la vacuna. 8 La inflamación y el daño tisular en el pulmón en este modelo animal recapitularon la inflamación y el daño tisular en los pulmones de los pacientes infectados con SARS que sucumbieron a la enfermedad. Con el curso del tiempo el daño peor ocurrió en forma retardada en sincronía con el aumento de la respuesta inmune. Sorprendentemente, los anticuerpos neutralizantes controlaron el virus en el animal, pero luego precipitaron una respuesta inflamatoria severa que daña los tejidos en el pulmón. Este es un perfil similar al de la enfermedad mediada por inmunocomplejos que se observaba con las vacunas contra el RSV (Respiratory syncytial virus) en el pasado, en el que los vacunados sucumbían a la enfermedad mortal por el RSV debido a la formación de complejos inmunes anticuerpo-virus que precipitaron respuestas inmunitarias inflamatorias dañinas. También es similar al curso clínico de los pacientes con COVID-19,9 con títulos que se correlacionan directamente con la gravedad de la enfermedad. 10 Por el contrario, los sujetos que se recuperan rápidamente pueden tener anticuerpos séricos anti-SARS-CoV-2 bajos o nulos. 11
La obtención de anticuerpos, específicamente los anticuerpos neutralizantes, es el objetivo de casi todas las vacunas candidatas actuales al SARS-CoV-2. La evidencia anterior de que es probable que ocurra en algún grado un aumento de la enfermedad dependiente de anticuerpos provocado por la vacuna con las vacunas COVID-19 es verticalmente consistente desde los estudios controlados del SARS en primates hasta las observaciones clínicas en el SARS y el COVID-19. Por lo tanto, un riesgo finito, no teórico, es evidente en la literatura médica de que las vacunas candidatas compuestas por la espícula viral del SARS ‐ CoV ‐ 2 y que provocan anticuerpos anti ‐ SARS ‐ CoV ‐ 2, ya sean neutralizantes o no, colocan a los vacunados en mayor riesgo, para la enfermedad COVID-19 más grave cuando se encuentran con virus circulantes. De hecho, los estudios en ratones de vacunas anteriores contra el SARS revelaron este fenotipo exacto,5 Independientemente, los candidatos a la vacuna del SARS / MERS, comúnmente exhibieron ADE asociado con alta morbilidad inflamatoria en modelos preclínicos, obstruyendo su avance a la clínica. 4 , 12 El ADE del SARS tanto de la enfermedad en primates no humanos como de la infección viral de células in vitro se asignó claramente a epítopos de espículas virales del SARS dirigidos a anticuerpos específicos.6 Este fenómeno fue constante en una variedad de plataformas de vacunas, incluido el ADN, los cebadores de vectores y las partículas similares a virus‐like particles (VLP), independientemente del método de inoculación (oral, intramuscular, subcutánea, etc.). Una variable desconocida es cuánto dura este daño tisular, lo que posiblemente resulte en una morbilidad permanente (p. Ej., Diabetes por daño pancreático 7 ).
Los datos actuales sobre las vacunas COVID ‐ 19 son limitados, pero hasta el momento no revelan pruebas de ADE de la enfermedad. Los estudios con primates no humanos de la vacuna mRNA ‐ 1273 de Moderna mostraron una protección sin inmunopatología detectable. 13 Los ensayos de fase 1 de varias vacunas no han informado ninguna inmunopatología en sujetos a los que se les administraron las vacunas candidatas. Sin embargo, era poco probable que estos sujetos se hubieran encontrado todavía con virus circulantes. 14 Sin embargo, todos los estudios preclínicos hasta la fecha se han realizado con el de Wuhan o cepas del virus estrechamente relacionadas, mientras que un virus D614G mutante es ahora la forma circulante más prevalente. Varias observaciones sugieren que esta forma alternativa puede ser antigénicamente distinta de la cepa derivada de Wuhan, no tanto en la composición, sino en la conformación de la espícula viral y la exposición de los epítopos de neutralización. 15 – 18 De manera similar, los ensayos clínicos de fase 1 y 2 de vacunas candidatas solo se han diseñado en torno a la inmunogenicidad como un punto final de eficacia y no se han diseñado para capturar la exposición de los sujetos al virus circulante después de la vacunación, que es cuando está diseñado para que ocurra el ADE / inmunopatología. Por lo tanto, la ausencia de evidencia de ADE en los datos de la vacuna COVID ‐ 19 hasta ahora no exime a los investigadores de revelar el riesgo de aumento de la enfermedad a los participantes del ensayo de la vacuna, y sigue siendo un riesgo realista, no teórico para los sujetos.
2 DESAFÍOS DEL CONSENTIMIENTO INFORMADO PARA ESTUDIOS DE VACUNA COVID-19
Los procedimientos de consentimiento informado para los ensayos de vacunas comúnmente incluyen la divulgación de riesgos muy menores, como reacciones en el lugar de la inyección, riesgos raros del pasado, vacunas / virus no relacionados , como el síndrome de Guillain-Barré para la gripe porcina (el evento reciente de mielitis transversa por vacuna) y declaraciones genéricas sobre el riesgo de eventos adversos sistémicos idiosincrásicos y muerte. Rara vez se incluyen los riesgos específicos para los participantes de la investigación derivados del mecanismo biológico, a menudo debido a la ambigüedad sobre su aplicabilidad. 19
Los formularios de consentimiento firmados de los ensayos de la vacuna COVID ‐ 19 no están disponibles públicamente debido a preocupaciones de privacidad. También varían de un sitio clínico a otro, y los formularios de consentimiento de muestra en los que se basan no deben divulgarse hasta después de que finalice el ensayo, si es que lo hacen. Sin embargo, estos formularios de consentimiento suelen ser muy similares en contenido a la sección “Riesgos para los participantes” de los protocolos del ensayo, que Pfizer, Moderna y Johnson & Johnson han publicado públicamente para sus ensayos de la vacuna COVID-19 ( 20 & Suplemento). Dado que estas tres vacunas son representativas de la diversidad de vacunas que se están probando, es muy probable que el formulario de consentimiento inferido de estos protocolos sea similar o idéntico a los de todos y cada uno de los ensayos de vacunas que se están realizando actualmente. Los tres protocolos mencionan el riesgo de mejora de la enfermedad por la vacuna, pero los tres enumeran este riesgo en último lugar o penúltimo en la lista de riesgos, después de los riesgos del vector Ad26 ‐ Cov2, los vectores de adenovirus en general, los riesgos de la vacunación en general, riesgos de embarazo y control de la natalidad (que se dice que son “desconocidos”), riesgos de extracción de sangre y riesgos de la recolección de muestras de frotis nasales (para la vacuna Johnson and Johnson), después de alergia, desmayo, reacción a la inyección local, reacciones adversas sistémicas generales y anomalías de laboratorio para la vacuna Moderna y después de reacciones de inyección en el sitio local y eventos adversos sistémicos generales para la vacuna Pfizer. Además, tanto Moderna como Johnson y Johnson denominan “teórico” el riesgo de mejora de la enfermedad provocada por la vacuna. Finalmente, al citar el riesgo, Pfizer y Moderna señalan evidencia previa de mejora de la enfermedad provocada por la vacuna con el Virus sincitial respiratorio (Respiratory syncytial virus) y el dengue, así como con el coronavirus felino (Pfizer) y el sarampión (Moderna); sin embargo, el SARS y el MERS no se mencionan. Johnson y Johnson analizan el SARS y el MERS, pero presentan un argumento científico inusual de que la mejora de la enfermedad provocada por la vacuna se debe a anticuerpos no neutralizantes y respuestas celulares sesgadas Th2 y que la vacunación con Ad26 no presenta este perfil. Los formularios de consentimiento en blanco para AstraZeneca y Johnson and Johnson también están disponibles en línea en https://restoringtrials.org/2020/09/18/covid19trialprotocolandstudydocs/ y aunque el formulario de AstraZeneca revela claramente el riesgo específico de ADE, la divulgación figura en último lugar entre riesgos únicamente en hoja informativa adjunta. En total, la evidencia de los protocolos de Pfizer, Moderna y Johnson & Johnson para sus ensayos de vacunas COVID-19 y los formularios de consentimiento de muestra, cuando se contrasta con la evidencia de la mejora de la enfermedad dependiente de anticuerpos presentada en este informe y ampliamente disponible para cualquier experto médico en el campo, establece que la comprensión del paciente del riesgo específico de que recibir la vacuna COVID-19 podría convertir a un sujeto en alguien que experimenta una enfermedad leve a alguien que experimenta una enfermedad grave,
Los estándares de ética médica requerían que, dada la extensión de la evidencia en la literatura médica revisada anteriormente, el riesgo de ADE debe distinguirse clara y enfáticamente en el consentimiento informado de los riesgos observados raramente, así como el riesgo más obvio de falta de eficacia, que no está relacionado con el riesgo específico de ADE. Con base en la literatura publicada, debería haber sido obvio para cualquier médico capacitado que existe un riesgo significativo para los sujetos de investigación de vacunas de que puedan experimentar una enfermedad grave una vez vacunados, mientras que solo pueden haber experimentado una enfermedad leve y autolimitada si no está vacunado. El consentimiento también debe distinguir claramente el riesgo específico de empeoramiento de la enfermedad COVID-19 de las declaraciones genéricas sobre el riesgo de muerte y el riesgo genérico de falta de eficacia de la vacuna.
3 CONCLUSIÓN
Dada la fuerte evidencia de que el ADE es un riesgo no teórico y convincente para las vacunas COVID-19, la divulgación del riesgo específico de empeoramiento de la enfermedad COVID-19 debido a la vacunación requiere un tratamiento específico, separado, formulario de consentimiento informado y demostración de la comprensión del paciente para cumplir con los estándares de ética médica. El proceso de consentimiento informado para los ensayos en curso de la vacuna COVID-19 no parece cumplir con este estándar. Si bien la emergencia sanitaria mundial de COVID-19 justifica los ensayos acelerados de vacunas de candidatos con responsabilidades conocidas, tal aceleración no es incompatible con la atención adicional que se presta a los procedimientos de consentimiento informado intensificados específicos para los riesgos de la vacuna COVID-19.
AGRADECIMIENTOS
Apoyado por el premio NIH R21AI157604 (a TC).
DIVULGAR
Los autores han declarado no tener ningún conflicto de intereses para este artículo.
https://cienciaysaludnatural.com/las-vacunas-contra-covid19-pueden-empeorar-la-enfermedad-tras-la-exposicion-al-coronavirus/
Fuente: Informed consent disclosure to vaccine trial subjects of risk of COVID‐19 vaccines worsening clinical disease https://doi.org/10.1111/ijcp.13795 – Department of Biochemistry and Molecular Pharmacology, NYU Langone Health, New York, NY, USA – Division of Comparative Pathology, Department of Pathology and Laboratory Medicine, Tulane University School of Medicine, Tulane National Primate Research Center, Covington, LA, USA

Las vacunas COVID ‐ 19 diseñadas para provocar anticuerpos neutralizantes pueden sensibilizar a los receptores de la vacuna a una enfermedad más grave que si no estuvieran vacunados. Existe un riesgo significativo para los sujetos que reciben las vacunas de que puedan experimentar una enfermedad grave una vez vacunados, mientras que solo pueden haber experimentado una enfermedad leve y autolimitada si no están vacunado. Los ensayos clínicos de fase 1 y 2 de vacunas candidatas solo se han diseñado en torno a la inmunogenicidad como un punto final de eficacia y no se han diseñado para capturar la exposición de los sujetos al virus circulante después de la vacunación, que es cuando está diseñado para que ocurra la mejora dependiente de anticuerpos (ADE) / inmunopatología. Por lo tanto, la ausencia de evidencia de ADE en los datos de la vacuna COVID ‐ 19 hasta ahora no exime a los investigadores de revelar el riesgo de aumento de la enfermedad a los participantes del ensayo de la vacuna, y sigue siendo un riesgo realista, no teórico para los sujetos.
Dada la fuerte evidencia de que el ADE es un riesgo no teórico y convincente para las vacunas COVID-19, la divulgación del riesgo específico de empeoramiento de la enfermedad COVID-19 debido a la vacunación requiere un tratamiento específico, separado en un formulario de consentimiento informado de facil comprensión del paciente para cumplir con los estándares de ética médica. El proceso de consentimiento informado para los ensayos en curso de la vacuna COVID-19 no parece cumplir con este estándar. Si bien la emergencia sanitaria mundial de COVID-19 justifica los ensayos acelerados de vacunas de candidatos con responsabilidades conocidas, tal aceleración no es incompatible con la atención adicional que se presta a los procedimientos de consentimiento informado específicos para los riesgos de la vacuna COVID-19.
Vigilancia de seguridad de la Adminsitación de Drogas y Alimentos, FDA: Lista de trabajo de posibles resultados de eventos adversos de las vacunas COVID-19
Sujeto a cambios
Síndrome de Guillain-Barré
Encefalomielitis diseminada aguda
Mielitis transversa
Encefalitis / mielitis / encefalomielitis /
meningoencefalitis / meningitis /
encefalopatía
Convulsiones / convulsiones
Accidente cerebrovascular
Narcolepsia y cataplejía
Anafilaxia
Infarto agudo de miocardio
Miocarditis / pericarditis
Enfermedad autoinmune
Muertes
Resultados del embarazo y el nacimiento
Otras enfermedades desmielinizantes agudas
Reacciones alérgicas no anafilácticas
Trombocitopenia
Coagulación intravascular diseminada
Tromboembolismo venoso
Artritis y artralgia / dolor articular
Enfermedad de Kawasaki
Síndrome inflamatorio multisistémico
en ninos
Enfermedad potenciada por la vacuna
Presentation: https://www.fda.gov/media/143557/download
Resumen
Objetivos del estudio
El objetivo del estudio fue determinar si existe suficiente bibliografía para exigir a los médicos que revelen el riesgo específico de que las vacunas COVID ‐ 19 pueden empeorar la enfermedad tras la exposición al virus de desafío o en circulación.
Métodos utilizados para realizar el estudio
Se revisó la literatura publicada para identificar evidencia preclínica y clínica de que las vacunas COVID-19 podrían empeorar la enfermedad tras la exposición al virus de desafío o circulante. Se revisaron los protocolos de ensayos clínicos para las vacunas COVID ‐ 19 para determinar si los riesgos se informaron adecuadamente.
Resultados del estudio
Las vacunas COVID ‐ 19 diseñadas para provocar anticuerpos neutralizantes pueden sensibilizar a los receptores de la vacuna a una enfermedad más grave que si no estuvieran vacunados. Las vacunas para el SARS, MERS y RSV ( Respiratory syncytial virus ) nunca han sido aprobadas, y los datos generados en el desarrollo y prueba de estas vacunas sugieren una seria preocupación mecanicista: que las vacunas diseñadas empíricamente usando el enfoque tradicional (que consiste en el pico viral de coronavirus no modificado o mínimamente modificado para provocan anticuerpos neutralizantes), ya sea que estén compuestos de proteína, vector viral, ADN o ARN e independientemente del método de administración, pueden empeorar la enfermedad por COVID-19 a través de la mejora dependiente de anticuerpos (ADE). Este riesgo está lo suficientemente oculto en los protocolos de los ensayos clínicos y los formularios de consentimiento para los ensayos en curso de la vacuna COVID-19 que es poco probable que ocurra una comprensión adecuada de este riesgo por parte del paciente.
Conclusiones extraídas del estudio e implicaciones clínicas
El riesgo específico y significativo de ADE al ser vacunado contra COVID-19 debería haber sido y debería ser divulgado de manera prominente e independiente a los sujetos de investigación que actualmente se encuentran en ensayos de vacunas, así como a aquellos que están siendo reclutados para los ensayos y futuros pacientes después de la aprobación de la vacuna, para cumplir con los estándar ético de comprensión del paciente para el consentimiento informado.
1 EL RIESGO DE ADE EN LAS VACUNAS COVID-19 NO ES TEÓRICO
La intensificación de la enfermedad provocada por la vacuna se observó previamente en sujetos humanos con vacunas para el virus sincitial respiratorio (RSV, Respiratory syncytial virus), el virus del dengue y el sarampión. 1 También se observó una intensificación de la enfermedad provocada por la vacuna con los virus SARS y MERS y con el coronavirus felino, que están estrechamente relacionados con el SARS ‐ CoV ‐ 2, el patógeno causante de la enfermedad COVID ‐ 19. Los mecanismos inmunes de esta mejora han involucrado invariablemente a los anticuerpos, desde la mejora directa dependiente de anticuerpos, hasta la formación de complejos inmunes por los anticuerpos, aunque acompañada de diversas respuestas celulares coordinadas, como la distorsión de las células T Th2. 2 – 7 En particular, se ha implicado tanto a los anticuerpos neutralizantes como a los no neutralizantes. Un estudio reciente reveló una lesión pulmonar aguda mediada por IgG in vivo en macacos infectados con SARS que se correlacionó con una respuesta de anticuerpos neutralizantes provocada por la vacuna. 8 La inflamación y el daño tisular en el pulmón en este modelo animal recapitularon la inflamación y el daño tisular en los pulmones de los pacientes infectados con SARS que sucumbieron a la enfermedad. Con el curso del tiempo el daño peor ocurrió en forma retardada en sincronía con el aumento de la respuesta inmune. Sorprendentemente, los anticuerpos neutralizantes controlaron el virus en el animal, pero luego precipitaron una respuesta inflamatoria severa que daña los tejidos en el pulmón. Este es un perfil similar al de la enfermedad mediada por inmunocomplejos que se observaba con las vacunas contra el RSV (Respiratory syncytial virus) en el pasado, en el que los vacunados sucumbían a la enfermedad mortal por el RSV debido a la formación de complejos inmunes anticuerpo-virus que precipitaron respuestas inmunitarias inflamatorias dañinas. También es similar al curso clínico de los pacientes con COVID-19,9 con títulos que se correlacionan directamente con la gravedad de la enfermedad. 10 Por el contrario, los sujetos que se recuperan rápidamente pueden tener anticuerpos séricos anti-SARS-CoV-2 bajos o nulos. 11
La obtención de anticuerpos, específicamente los anticuerpos neutralizantes, es el objetivo de casi todas las vacunas candidatas actuales al SARS-CoV-2. La evidencia anterior de que es probable que ocurra en algún grado un aumento de la enfermedad dependiente de anticuerpos provocado por la vacuna con las vacunas COVID-19 es verticalmente consistente desde los estudios controlados del SARS en primates hasta las observaciones clínicas en el SARS y el COVID-19. Por lo tanto, un riesgo finito, no teórico, es evidente en la literatura médica de que las vacunas candidatas compuestas por la espícula viral del SARS ‐ CoV ‐ 2 y que provocan anticuerpos anti ‐ SARS ‐ CoV ‐ 2, ya sean neutralizantes o no, colocan a los vacunados en mayor riesgo, para la enfermedad COVID-19 más grave cuando se encuentran con virus circulantes. De hecho, los estudios en ratones de vacunas anteriores contra el SARS revelaron este fenotipo exacto,5 Independientemente, los candidatos a la vacuna del SARS / MERS, comúnmente exhibieron ADE asociado con alta morbilidad inflamatoria en modelos preclínicos, obstruyendo su avance a la clínica. 4 , 12 El ADE del SARS tanto de la enfermedad en primates no humanos como de la infección viral de células in vitro se asignó claramente a epítopos de espículas virales del SARS dirigidos a anticuerpos específicos.6 Este fenómeno fue constante en una variedad de plataformas de vacunas, incluido el ADN, los cebadores de vectores y las partículas similares a virus‐like particles (VLP), independientemente del método de inoculación (oral, intramuscular, subcutánea, etc.). Una variable desconocida es cuánto dura este daño tisular, lo que posiblemente resulte en una morbilidad permanente (p. Ej., Diabetes por daño pancreático 7 ).
Los datos actuales sobre las vacunas COVID ‐ 19 son limitados, pero hasta el momento no revelan pruebas de ADE de la enfermedad. Los estudios con primates no humanos de la vacuna mRNA ‐ 1273 de Moderna mostraron una protección sin inmunopatología detectable. 13 Los ensayos de fase 1 de varias vacunas no han informado ninguna inmunopatología en sujetos a los que se les administraron las vacunas candidatas. Sin embargo, era poco probable que estos sujetos se hubieran encontrado todavía con virus circulantes. 14 Sin embargo, todos los estudios preclínicos hasta la fecha se han realizado con el de Wuhan o cepas del virus estrechamente relacionadas, mientras que un virus D614G mutante es ahora la forma circulante más prevalente. Varias observaciones sugieren que esta forma alternativa puede ser antigénicamente distinta de la cepa derivada de Wuhan, no tanto en la composición, sino en la conformación de la espícula viral y la exposición de los epítopos de neutralización. 15 – 18 De manera similar, los ensayos clínicos de fase 1 y 2 de vacunas candidatas solo se han diseñado en torno a la inmunogenicidad como un punto final de eficacia y no se han diseñado para capturar la exposición de los sujetos al virus circulante después de la vacunación, que es cuando está diseñado para que ocurra el ADE / inmunopatología. Por lo tanto, la ausencia de evidencia de ADE en los datos de la vacuna COVID ‐ 19 hasta ahora no exime a los investigadores de revelar el riesgo de aumento de la enfermedad a los participantes del ensayo de la vacuna, y sigue siendo un riesgo realista, no teórico para los sujetos.
2 DESAFÍOS DEL CONSENTIMIENTO INFORMADO PARA ESTUDIOS DE VACUNA COVID-19
Los procedimientos de consentimiento informado para los ensayos de vacunas comúnmente incluyen la divulgación de riesgos muy menores, como reacciones en el lugar de la inyección, riesgos raros del pasado, vacunas / virus no relacionados , como el síndrome de Guillain-Barré para la gripe porcina (el evento reciente de mielitis transversa por vacuna) y declaraciones genéricas sobre el riesgo de eventos adversos sistémicos idiosincrásicos y muerte. Rara vez se incluyen los riesgos específicos para los participantes de la investigación derivados del mecanismo biológico, a menudo debido a la ambigüedad sobre su aplicabilidad. 19
Los formularios de consentimiento firmados de los ensayos de la vacuna COVID ‐ 19 no están disponibles públicamente debido a preocupaciones de privacidad. También varían de un sitio clínico a otro, y los formularios de consentimiento de muestra en los que se basan no deben divulgarse hasta después de que finalice el ensayo, si es que lo hacen. Sin embargo, estos formularios de consentimiento suelen ser muy similares en contenido a la sección “Riesgos para los participantes” de los protocolos del ensayo, que Pfizer, Moderna y Johnson & Johnson han publicado públicamente para sus ensayos de la vacuna COVID-19 ( 20 & Suplemento). Dado que estas tres vacunas son representativas de la diversidad de vacunas que se están probando, es muy probable que el formulario de consentimiento inferido de estos protocolos sea similar o idéntico a los de todos y cada uno de los ensayos de vacunas que se están realizando actualmente. Los tres protocolos mencionan el riesgo de mejora de la enfermedad por la vacuna, pero los tres enumeran este riesgo en último lugar o penúltimo en la lista de riesgos, después de los riesgos del vector Ad26 ‐ Cov2, los vectores de adenovirus en general, los riesgos de la vacunación en general, riesgos de embarazo y control de la natalidad (que se dice que son “desconocidos”), riesgos de extracción de sangre y riesgos de la recolección de muestras de frotis nasales (para la vacuna Johnson and Johnson), después de alergia, desmayo, reacción a la inyección local, reacciones adversas sistémicas generales y anomalías de laboratorio para la vacuna Moderna y después de reacciones de inyección en el sitio local y eventos adversos sistémicos generales para la vacuna Pfizer. Además, tanto Moderna como Johnson y Johnson denominan “teórico” el riesgo de mejora de la enfermedad provocada por la vacuna. Finalmente, al citar el riesgo, Pfizer y Moderna señalan evidencia previa de mejora de la enfermedad provocada por la vacuna con el Virus sincitial respiratorio (Respiratory syncytial virus) y el dengue, así como con el coronavirus felino (Pfizer) y el sarampión (Moderna); sin embargo, el SARS y el MERS no se mencionan. Johnson y Johnson analizan el SARS y el MERS, pero presentan un argumento científico inusual de que la mejora de la enfermedad provocada por la vacuna se debe a anticuerpos no neutralizantes y respuestas celulares sesgadas Th2 y que la vacunación con Ad26 no presenta este perfil. Los formularios de consentimiento en blanco para AstraZeneca y Johnson and Johnson también están disponibles en línea en https://restoringtrials.org/2020/09/18/covid19trialprotocolandstudydocs/ y aunque el formulario de AstraZeneca revela claramente el riesgo específico de ADE, la divulgación figura en último lugar entre riesgos únicamente en hoja informativa adjunta. En total, la evidencia de los protocolos de Pfizer, Moderna y Johnson & Johnson para sus ensayos de vacunas COVID-19 y los formularios de consentimiento de muestra, cuando se contrasta con la evidencia de la mejora de la enfermedad dependiente de anticuerpos presentada en este informe y ampliamente disponible para cualquier experto médico en el campo, establece que la comprensión del paciente del riesgo específico de que recibir la vacuna COVID-19 podría convertir a un sujeto en alguien que experimenta una enfermedad leve a alguien que experimenta una enfermedad grave,
Los estándares de ética médica requerían que, dada la extensión de la evidencia en la literatura médica revisada anteriormente, el riesgo de ADE debe distinguirse clara y enfáticamente en el consentimiento informado de los riesgos observados raramente, así como el riesgo más obvio de falta de eficacia, que no está relacionado con el riesgo específico de ADE. Con base en la literatura publicada, debería haber sido obvio para cualquier médico capacitado que existe un riesgo significativo para los sujetos de investigación de vacunas de que puedan experimentar una enfermedad grave una vez vacunados, mientras que solo pueden haber experimentado una enfermedad leve y autolimitada si no está vacunado. El consentimiento también debe distinguir claramente el riesgo específico de empeoramiento de la enfermedad COVID-19 de las declaraciones genéricas sobre el riesgo de muerte y el riesgo genérico de falta de eficacia de la vacuna.
3 CONCLUSIÓN
Dada la fuerte evidencia de que el ADE es un riesgo no teórico y convincente para las vacunas COVID-19, la divulgación del riesgo específico de empeoramiento de la enfermedad COVID-19 debido a la vacunación requiere un tratamiento específico, separado, formulario de consentimiento informado y demostración de la comprensión del paciente para cumplir con los estándares de ética médica. El proceso de consentimiento informado para los ensayos en curso de la vacuna COVID-19 no parece cumplir con este estándar. Si bien la emergencia sanitaria mundial de COVID-19 justifica los ensayos acelerados de vacunas de candidatos con responsabilidades conocidas, tal aceleración no es incompatible con la atención adicional que se presta a los procedimientos de consentimiento informado intensificados específicos para los riesgos de la vacuna COVID-19.
AGRADECIMIENTOS
Apoyado por el premio NIH R21AI157604 (a TC).
DIVULGAR
Los autores han declarado no tener ningún conflicto de intereses para este artículo.
Referencias:
- 1 Huisman W, Martina BE, Rimmelzwaan GF, Gruters RA, Osterhaus AD. Vaccine‐induced enhancement of viral infections. Vaccine. 2009; 27: 505‐ 512.Crossref CAS PubMed Web of Science®Google Scholar
- 2 Boyoglu‐Barnum S, Chirkova T, Anderson LJ. Biology of infection and disease pathogenesis to guide RSV vaccine development. Front Immunol. 2019; 10: 1675.Crossref CAS PubMed Web of Science®Google Scholar
- 3 Chen WH, Hotez PJ, Bottazzi ME. Potential for developing a SARS‐CoV receptor‐binding domain (RBD) recombinant protein as a heterologous human vaccine against coronavirus infectious disease (COVID)‐19. Human Vacc Immunother. 2020; 16: 1239‐ 1242.Crossref CAS PubMed Web of Science®Google Scholar
- 4 Jiang S, He Y, Liu S. SARS vaccine development. Emerg Infect Dis. 2005; 11: 1016‐ 1020.Crossref CAS PubMed Web of Science®Google Scholar
- 5 Tseng CT, Sbrana E, Iwata‐Yoshikawa N, et al. Immunization with SARS coronavirus vaccines leads to pulmonary immunopathology on challenge with the SARS virus. PLoS One. 2012; 7:e35421.Crossref CAS PubMed Web of Science®Google Scholar
- 6 Wang Q, Zhang L, Kuwahara K, et al. Immunodominant SARS coronavirus epitopes in humans elicited both enhancing and neutralizing effects on infection in non‐human primates. ACS Infect Dis. 2016; 2: 361‐ 376.Crossref CAS PubMed Web of Science®Google Scholar
- 7 Yang JK, Lin SS, Ji XJ, Guo LM. Binding of SARS coronavirus to its receptor damages islets and causes acute diabetes. Acta Diabetol. 2010; 47: 193‐ 199.Crossref CAS PubMed Web of Science®Google Scholar
- 8 Liu L, Wei Q, Lin Q, et al. Anti‐spike IgG causes severe acute lung injury by skewing macrophage responses during acute SARS‐CoV infection. JCI insight. 2019; 4:e123158.Crossref PubMed Web of Science®Google Scholar
- 9 Liu ZL, Liu Y, Wan LG, et al. Antibody profiles in mild and severe cases of COVID‐19. Clin Chem. 2020; 66: 1102– 1104.Crossref PubMed Web of Science®Google Scholar
- 10 Piccoli L, Park YJ, Tortorici MA, et al. Mapping neutralizing and immunodominant sites on the SARS‐CoV‐2 spike receptor‐binding domain by structure‐guided high‐resolution serology. Cell. 2020; S0092‐8674: 31234‐4Google Scholar
- 11 Robbiani DF, Gaebler C, Muecksch F, et al. Convergent antibody responses to SARS‐CoV‐2 infection in convalescent individuals. bioRxiv. 2020.Google Scholar
- 12 Yong CY, Ong HK, Yeap SK, Ho KL, Tan WS. Recent advances in the vaccine development against middle east respiratory syndrome‐coronavirus. Front Microbiol. 2019; 10: 1781.Crossref PubMed Web of Science®Google Scholar
- 13 Corbett KS, Flynn B, Foulds KE, et al. Evaluation of the mRNA‐1273 Vaccine against SARS‐CoV‐2 in Nonhuman Primates. N Engl J Med. 2020; 383: 1544– 1555.Crossref CAS PubMed Web of Science®Google Scholar
- 14 Mulligan MJ, Lyke KE, Kitchin N, et al. Phase 1/2 study of COVID‐19 RNA vaccine BNT162b1 in adults. Nature. 2020; 586: 589– 593.Crossref CAS PubMed Web of Science®Google Scholar
- 15 Becerra‐Flores M, Cardozo T. SARS‐CoV‐2 viral spike G614 mutation exhibits higher case fatality rate. Int J Clin Pract. 2020; 74:e13525.Wiley Online Library CAS PubMed Web of Science®Google Scholar
- 16 Korber B, Fischer WM, Gnanakaran S, et al. Tracking changes in SARS‐CoV‐2 spike: evidence that D614G increases infectivity of the COVID‐19 virus. Cell. 2020; 182: 812‐ 827.e819.Crossref CAS PubMed Web of Science®Google Scholar
- 17 Mansbach RA, Chakraborty S, Nguyen K, Montefiori D, Korber B, Gnanakaran S. The SARS‐CoV‐2 spike variant D614G favors an open conformational state. bioRxiv. 2020.PubMed Google Scholar
- 18 Zhang L, Jackson C, Mou H, et al. The D614G mutation in the SARS‐CoV‐2 spike protein reduces S1 shedding and increases infectivity. bioRxiv. 2020.Google Scholar
- 19 Wendler D. What should be disclosed to research participants? Am J Bioeth. 2013; 13: 3‐ 8.Crossref PubMed Web of Science®Google Scholar
- 20 McNamara D. Three Major COVID Vaccine Developers Release Detailed Trial Protocols. https://wwwmedscapecom/viewarticle/937845; 2020.Google Scholar
https://cienciaysaludnatural.com/las-vacunas-contra-covid19-pueden-empeorar-la-enfermedad-tras-la-exposicion-al-coronavirus/
Última edición: